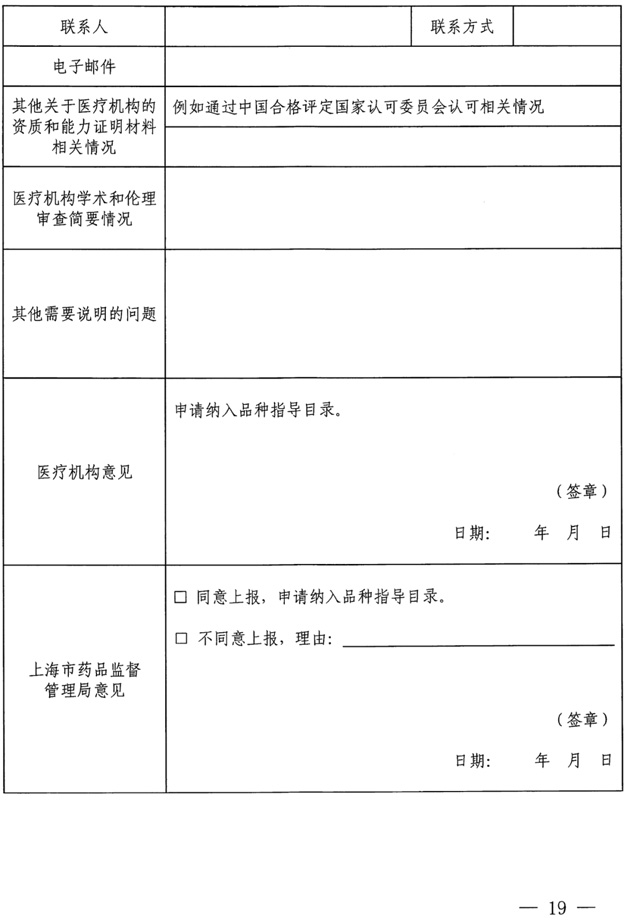
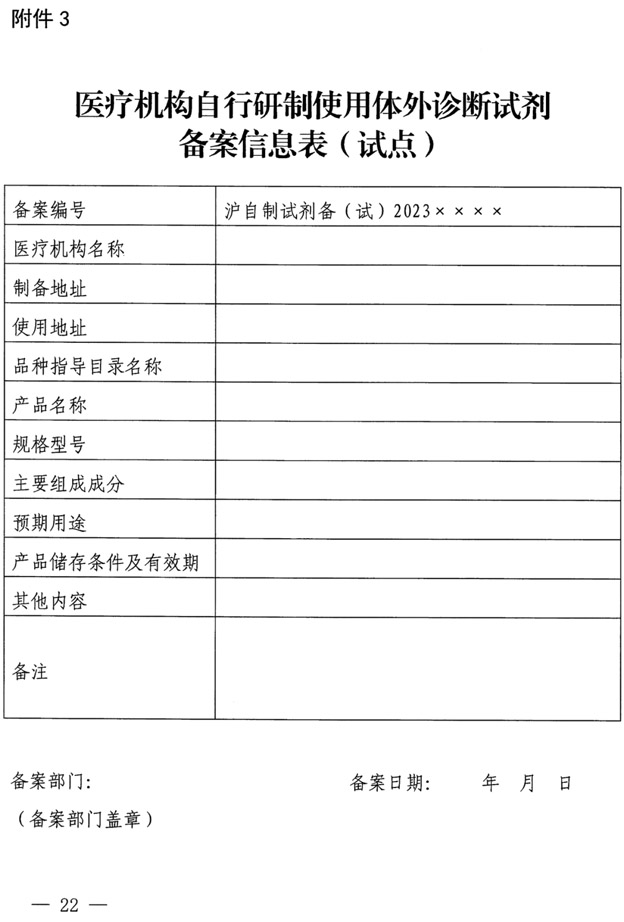
临床质谱LDT最新政策汇总,北京、上海共10家医院开展LDT体外诊断试剂试点
2023-05-20 00:00:00 体外诊断价值圈 5382

在美国,实验室自建方法(LDT)包括所有未经食品药品监督管理局(FDA)批准,以及FDA批准后又经过实质性修改的方法。被允许使用的LDT必须与FDA批准的方法具有相同的分析质量水平。在纽约州,LDT仅在经过严格的审查程序批准后才能用于临床样品的检测。通过对纽约州卫生厅审批的与临床质谱LDT方法学相关的一千多篇文献的查阅和分析,本研究总结了其中存在的主要问题,并对相关问题进行了解析,提出解决方案。这些问题主要来源于7个方面,包括色谱、内标、方法验证中所使用的样品基质、线性验证、基质效应、参考区间和室内质量控制。
实验室自建方法(laboratory developed test,LDT)起初是指由实验室自行设计、生产并在实验室所属医疗机构内部用于患者体外诊断的测试方法。其检测原理和操作方法相对简单,风险低,主要用于诊断罕见疾病,比如,宫颈癌细胞显微镜检查方法。
而如今在美国,尽管LDT测试只允许在获得CLIA′88认证资质的实验室中进行,但由于LDT方法经常含有未经美国食品药品监督管理局(Food and Drug Administration,FDA)监管的成分,并且常用于常见疾病的诊断和治疗,所以与起初相比,其应用风险明显升高。随着科技的发展,LDT方法学也变得多样化并且更加复杂,在临床诊断和治疗中发挥着越来越重要的作用。
纽约卫生厅是FDA委托的LDT的第三方评审单位,其评审范围包括:所有未经美国FDA批准的LDT;已经获得美国FDA批准,但经过重大修改的体外诊断试剂。除此之外,还包括:分析物特异性试剂,如抗体检测及核酸测序试剂;用于产品开发而非临床使用的试剂方法产品;仅供科研使用的试剂/方法产品。纽约州法规规定符合上述情况的LDT经审批后方可由纽约州卫生厅认证的临床实验室用于临床检测。自2003年4月至2019年末,纽约卫生厅审批的LDT方法总数超过15 000件,其中质谱方法占10%~15%。
LDT评审内容
在LDT评审过程中,主要的审阅内容包括以下方面:(1)分析方法和临床有效性验证;(2)采样:样品采集和运输的条件,以及接受/拒绝样品的标准;(3)试剂:组成、制备程序、存储条件及稳定性;(4)校准/标准品:来源、纯度、校准液制备程序、存储条件要求、稳定性、批间差及接受/拒绝标准;(5)内标:性质、来源、纯度、内标液制备程序和存储条件要求;(6)室内质量控制(quality control,QC):质控物材料的性质、制备程序、存储条件、稳定性、批间差及接受和拒绝标准;QC的浓度和频率;QC通过/失败的标准及失败后采取的措施;(7)方法操作过程:样品处理过程、色谱条件和质谱的参数;(8)结果报告:结果的计算、参考范围和解释;(9)自运行或无官方室间质评项目的质量评价方式。
其中在方法验证方面,主要的评审内容包括:分析灵敏度(最低检测浓度及最低定量浓度);精密度(日内和日间);正确度(或准确度),包括方法比对和/或加标回收率试验;稀释线性;可报告范围;携带污染;患者样品稳定性;分析特异性;干扰评估;基质效应和参考范围。
临床检验与实验室自建检测(LDTs)
时间
政策及通知发布
2013.9月
国卫医医护便函 【2013】第103号
国家卫计委医政医管局《关于同意开展个性化医学检测试点的函》
个性化医学检测试点单位:
中国医科大学附属第一医院、中南大学湘雅医学检验所、北京博奥医学检验所等三家单位。 2014.1月
深圳市发展和改革委员会《深圳国际生物谷总体发展规划(2013-2020年)》
研究借鉴“实验室自主开发检测方法”(LDTs)等先进国家或地区的监管模式,吸引一批临床基因检测机构入驻,稳步推广基因检测服务。 2019.9月
沪府发〔2019〕16号
《健康上海行动(2019-2030年)》
发展实验室自建检测方法(LDT)。建立完善实验室自建检测方法(LDT)的管理要求和技术规范,实施LDT试点,加强对各临床实验室LDT项目开展情况的监管,评估LDT试点工作开展的情况及效果,逐步推广LDT临床应用,开展LDT项目培训与国际交流。至2022年,探索推进LDT的临床研究应用,以加强医学科学的创新研究和成果转化,满足临床的实际需求,促进健康服务业的新一轮发展。至2030年,深入开展LDT临床研究应用,推进健康服务业发展。2021.2月
国务院令第739号
《医疗器械监督管理条例》
第53条:对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可以自行研制,在执业医师指导下在本单位内使用。具体管理办法由国务院药品监督管理部门会同国务院卫生主管部门制定。
2021.7月
中共中央 国务院
《关于支持浦东新区高水平改革开放打造社会主义现代化建设引领区的意见》
允许有条件的医疗机构按照相关要求开展自行研制体外诊断试剂试点。涉及单位:
浦东新区有条件的医疗机构。2021.12月
沪府办发【2021】31号
上海市政府办公厅《关于推进上海市公立医院高质量发展的实施方案》
允许有条件的医院按照国家要求开展自行研制体外诊断试剂试点。 2022.4月
《广州市战略性新兴产业发展“十四五”规划》
积极支持实验室自建检测方法(LDT)试点,有条件允许LDT项目服务于临床推广。
2022.4月
广州市发改委
《广州市加快推进医学检验产业集群发展实施方案》
(三)发展实验室自建检测方法(LDT)项目。支持第三方医学检验机构开展LDT项目业务,探索形成有关指导原则和管理办法,通过医疗机构试点、项目备案等措施,有条件允许自主创新、已验证安全性和有效性的LDT项目服务于临床推广。2022年8月,广州市发改委组织会议,生物产业联盟及金域、达安临检、万孚、华银、燃石、基准医疗等代表参加会议。
2022.10月
杭政办函【2022】59号
杭州市人民政府办公厅《关于加快生物医药产业高质量发展的若干措施》
积极支持实验室自建检测方法(LDT)试点,有条件允许LDT项目服务于临床推广。
2022.10月
沪卫医改【2022】11号
上海市卫健委《关于开展上海市公立医院高质量试点工作的通知》
通知附件2试点单位推进公立医院高质量发展重点任务:有条件的医院可按照有关规定开展自行研制体外诊断试剂试点。
(试点单位中的市级医院和区属医院,辅导试点单位参照实施。)
试点单位:
中山医院、华山医院、复旦妇产科医院、瑞金医院、仁济医院、上海儿童医学中心、
上海市第一人民医院 、上海市精神卫生中心、龙华医院、曙光医院等10家市级医院;
东方医院、徐汇区中心医院、同仁医院、复旦金山医院、上海市第五人民医院、杨浦区中心医院、中山医院青浦分院、松江区中心医院、普陀区中心医院、上海市中西医结合医院等10家区级医院。
辅导试点单位:
新华医院、上海市第六人民医院、上海市第十人民医院、复旦肿瘤医院、上海市胸科医院、
复旦耳鼻喉科医院、上海市肺科医院、复旦儿科医院、上海市一妇婴、上海市儿童医院、同济口腔医院等11家市级医院;
嘉定区中心医院、奉贤区中心医院、浦东医院、闸北中心医院、上海市第四人民医院、崇明医院、吴淞中心医院、第九人民医院黄埔分院、上海市第七人民医院等9家区属医院。
2022.12月
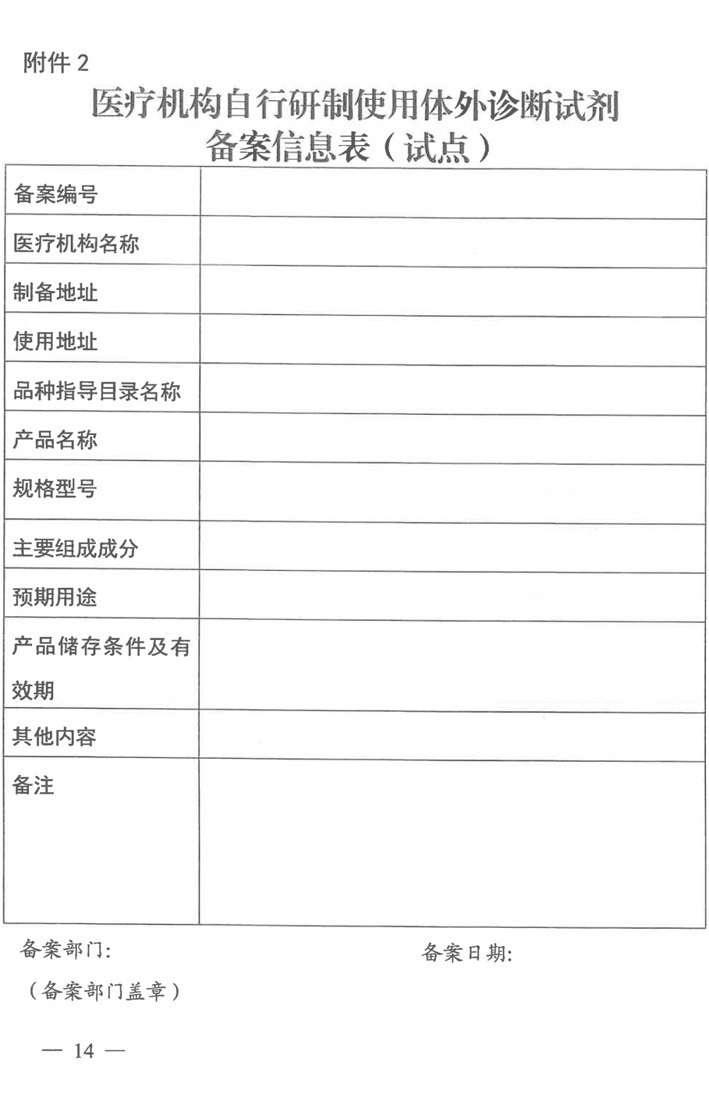
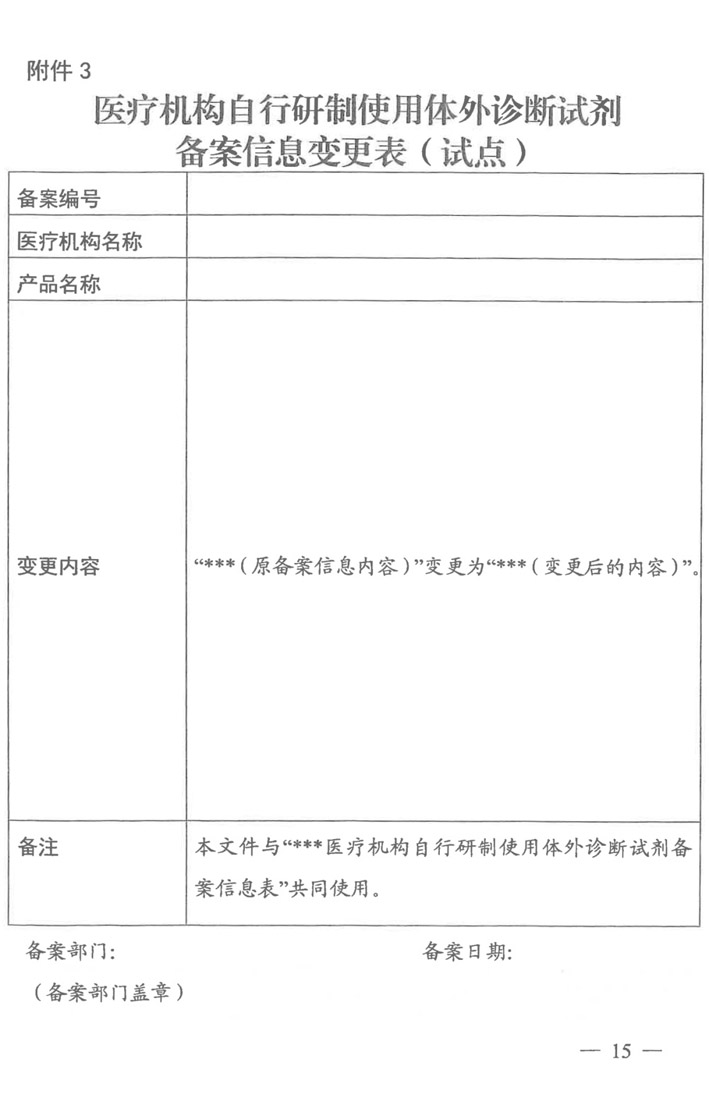
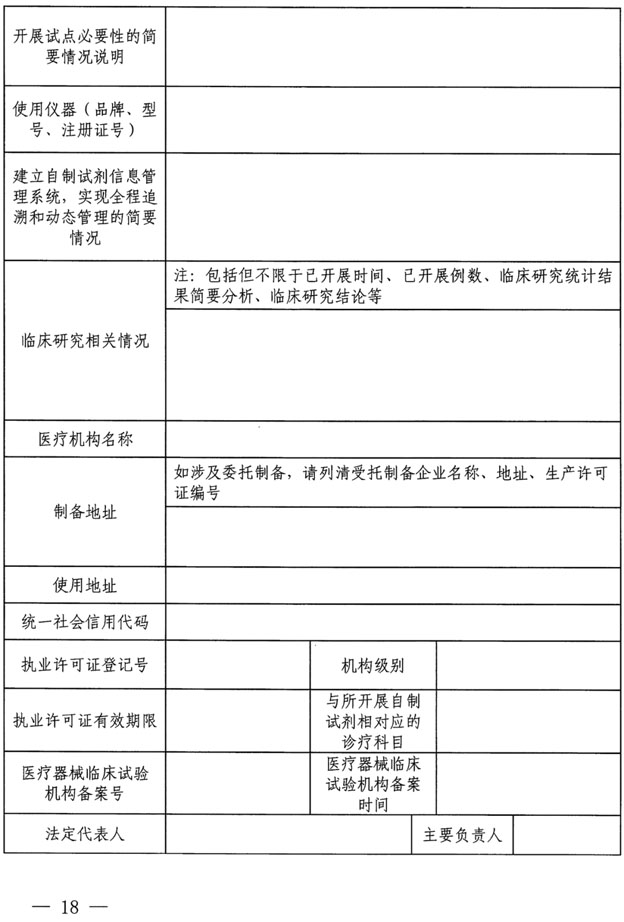
药监综械注【2022】101号 国家药监局综合司、国家卫健委办公厅《关于开展医疗机构自行研制使用体外诊断试剂试点的工作通知》 涉及单位:
北京协和医院、北京医院、中日友好医院、中国医学科学院肿瘤医院、中国医学科学院阜外医院、北京大学第一医院。
2023.1月
全国医疗器械监督管理工作会议
支持重点区域监管创新和产业发展,
持续夯实注册管理法制基础,
扎实开展自制试剂试点,
维护注册管理良好秩序,
加强审评审批能力建设,
强化临床试验管理,
持续深化专项整治。
2023.3月
沪药监械注【2023】55号
上海市药品监督管理局,上海市卫生健康委员会《上海市医疗机构自行研制使用体外诊断试剂试点实施方案》涉及单位:
复旦大学附属肿瘤医院、上海交通大学医学院附属上海儿童医学中心、复旦大学附属中山医院、上海交通大学医学院附属瑞金医院。
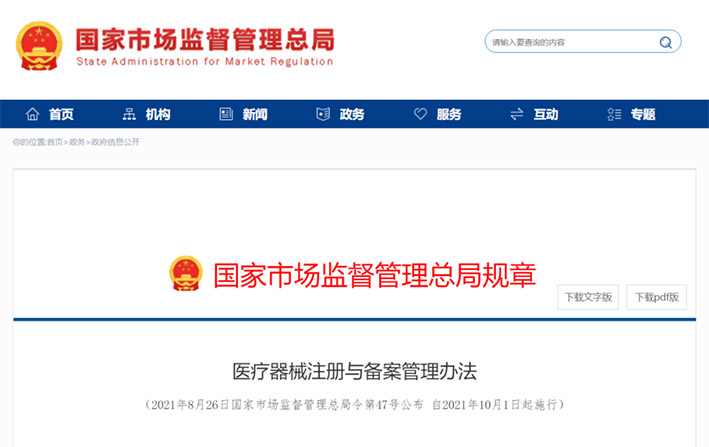
2021年2月9日,国务院总理李克强签署第739号国务院令,公布新《医疗器械监督管理条例》(以下简称《条例》)。为贯彻实施新《条例》,落实医疗器械审评审批制度改革要求,建立更加科学的医疗器械监督管理制度,加强医疗器械注册管理,国家药监局组织对原《医疗器械注册管理办法》《体外诊断试剂注册管理办法》进行修订。

中华人民共和国国务院令 第739号 全文链接:https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20210319202057136.html
2021年8月26日,国家市场监督管理总局令第47号,国家市场监督管理总局令第48号公布。国家市场监督管理总局2021年第11次局务会议审议通过《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》(简称两个《办法》),自2021年10月1日起施行。
国家市场监督管理总局 全文链接: https://gkml.samr.gov.cn/nsjg/fgs/202108/t20210831_334228.html
国家市场监督管理总局 全文链接:https://gkml.samr.gov.cn/nsjg/fgs/202108/t20210831_334232.html 药监综械注【2022】101号 国家药监局综合司、国家卫健委办公厅《关于开展医疗机构自行研制使用体外诊断试剂试点的工作通知》红头文件全文